Требования к постоянному сосудистому доступу
Основные принципы рационального использования ресурса сосудов
Наличие множества вариантов формирования ПСД для проведения программного гемодиализа требует тщательного выбора и планирования каждой операции. При этом необходимо учитывать как ближайший результат операции, так и отдаленную перспективу больного возможностью последующих реконструктивных вмешательств.
- Выбор вида операции должен производиться с учетом возрастных, конституциональных и нозологических особенностей больного, а также степени сохранности периферических сосудов.
- Формирование нативной АВФ является методом выбора вида ПСД. Применение ССП для создания ПСД абсолютно показано только в тех случаях, когда полностью отсутствуют или использованы возможности формирования нативной АВФ. Это обусловлено лучшей сохранностью функции нативных АВФ, меньшим количеством необходимых корригирующих процедур в ближайшем и отдаленном послеоперационном периоде, меньшей частотой инфекционных осложнений, относительной простотой технического выполнения, более низкой себестоимостью по сравнению с использованием ССП.
- Локализация АВФ - возможно наиболее дистальный участок поверхностной вены с учетом необходимости создания артерио-венозного соустья достаточного диаметра и возможных косметических по следствий. Такой подход позволяет сделать доступным для пункций максимально протяженный отрезок вены, обеспечить возможность для необходимых реконструктивных вмешательств на проксимальной части сосудов, уменьшить вероятность возникновения синдрома "обкрадывания" или сердечной недостаточности по причине неадекватно большого сброса артериальной крови в венозное русло. При сходных топографо-анатомических характеристиках сосудов на обеих конечностях выбор стороны операции осуществляется с учетом пожеланий пациента. В большинстве случаев имеется возможность формирования ПСД не на доминантной руке, которая субъективно более функционально значима для больного (вождение автомобиля, ношение часов и т. п.).
- Формирование АВФ только по типу "конец вены - в бок артерии" в антеградном направлении. Полный отказ от создания "ретроградных" АВФ. Такой подход обеспечивает радикальное снижение частоты синдрома "обкрадывания" и синдрома венозной гипертензии, а также количества необходимых корригирующих операций. Следует пояснить, что отказ от формирования "ретроградных" АВФ подразумевает под собой наличие материальных и технических возможностей для имплантации (в случае необходимости) ССП. При отсутствии таких возможностей и исчерпании ресурсов сосудов для создания других видов АВФ формирование "ретроградной" фистулы может быть признано оправданным.
- Применение дополнительных инструментальных методов исследования (рентгеноконтрастная фистулография, допплер-сонография) позволяет своевременно диагностировать развитие осложнений ПСД, что способствует их успешной профилактике и коррекции.
- При развитии осложнений со стороны ПСД, утрате функции или плохих эксплуатационных качествах приоритет отдается ранним реконструктивным вмешательствам, направленным на восстановление или улучшение функции ПСД. Только при невозможности или неэффективности такого вмешательства рассматривается вопрос о формировании ПСД с использованием других интактных сосудов.
Применение этих принципов на практике позволяет обеспечить длительное функционирование ПСД, максимально сократить риск воз можных осложнений, создать условия для успешных реконструктивных вмешательств, рационально использовать ресурс сосудов. При тщательном отборе пациентов, своевременном планировании и выборе вида сосудистого доступа, регулярном мониторинге его состояния успех в формировании и реконструкции ПСД может быть обеспечен в абсолютном большинстве случаев. Наибольший прогресс в этой области возможен при достижении тесного взаимодействия специально подготовленных хирургов и нефрологов центра гемодиализа на основе единой политики в отношении ПСД.
Требования к постоянному сосудистому доступу
Планируемый ПСД должен быть оценен с точки зрения его функциональных качеств, надежности и безопасности. Он должен отвечать следующим требованиям:
- адекватность, то есть способность обеспечивать кровоток через диализатор не менее 250-300 мл/мин и иметь кровоток не более 1000 мл/мин в АВФ и 1500 мл/мин в ССП. При меньших показателях кровотока значительно снижается эффективность проводимого гемо диализа, требуется увеличение его продолжительности, что неблагожелательно сказывается на состоянии пациента и затрудняет работу центра гемодиализа. Показатели кровотока выше указанных параметров связаны с повышением риска развития таких осложнений, как сердечная недостаточность (по причине вынужденного увеличения сердечного выброса) [Besarab A. et al., 2001; Ori Y. etal., 2002], синдром "обкрадывания", образование аневризм;
- доступность для пункций;
- достаточная протяженность, позволяющая обеспечить смену точек пункции ПСД (способствует длительному функционированию ПСД, снижает риск развития аневризмы фистульной вены) и необходимое расстояние между артериальной и венозной иглами (профилактика рециркуляции крови);
- безопасность - минимальный риск опасных для здоровья и жизни осложнений;
- физиологичность - не нарушать двигательных и чувствительных функций больного;
- комфортность для пациента - возможность его нахождения на сеансе гемодиализа непрерывно в течение 3,5-4 часов;
- косметичность - возможность скрытия послеоперационного рубца под одеждой (особенно актуально для женщин), что является одним из факторов отказа от формирования АВФ в "анатомической табакерке".
Тактика этапного ангиохирургического обеспечения больных на гемодиализе
С целью стандартизации и повышения эффективности оперативных вмешательств, направленных на создание и поддержание функции ПСД у каждого пациента, нами рекомендуется тактика этапного ангиохирургического обеспечения больных на программном гемодиализе. В нее входят те виды доступов к сосудам, которые при необходимости надлежит использовать в строго определенной последовательности. Этапность тактики заключается не только в соблюдении этой последовательности, но и в том, что каждое вмешательство, являясь логическим продолжением предыдущего, в то же время во многих случаях подготавливает оптимальные условия для выполнения последующего.
Рекомендуемые для практического применения в современных условиях типы ПСД классифицируются нами как первичные (дистальные АВФ), вторичные (проксимальные АВФ) и третичные (имплантация ССП). В основу такой классификации положены очередность их формирования и соответствие этапам тактики (табл. 1 и рис. 2).
| Этап | Тип ПСД | Вид и локализация ПСД |
|---|---|---|
| I | первичный (дистальные АВФ) | АВФ "конец v. cephalica - в бок a. radial is" в нижней и средней третях предплечья |
| II | вторичный (проксимальные АВФ) | АВФ "конец v. intermedia cubiti (v. intermedia cephalica, v. intermedia basilica), v. cephalica, v. basilica - в бок a. brachialis (a. radialis,a. ulnaris) в верхней трети предплечья или нижней трети плеча" |
| III | третичный (имплантация ССП) | все виды ПСД с применением ССП в любой локализации |
Таблица №1. Виды сосудистых доступов на этапах формирования.
Любой кандидат на первичное или повторное формирование со судистого доступа должен быть оценен с позиции целесообразности выбора конкретного вида ПСД, который определяется исходными анатомо-физиологическими особенностями пациента и неудачными исходами предшествующих операций. Соблюдение очередности этапов желательно, но не всегда достижимо. У ряда пациентов первый ПСД обеспечивается путем формирования сосудистого доступа, соответствующего II и даже III этапу.
На первом этапе используются наиболее простые виды АВФ (дистальные), которые возможно сформировать у абсолютного большинства пациентов, у которых до этого не выполнялись хирургические вмешательства на сосудах верхних конечностей. Рациональное использование для формирования дистальных АВФ только двух сосудов предплечья - a. radialis и v. cephalica - обеспечивает надежный и длительно функционирующий доступ. Сохранность функции впервые сформированной дистальной АВФ в течение 1 года без повторных вмешательств по данным разных авторов составляет от 54% до 85% [Ascher Е. et al., 2000; Berman S.S. and Gentile A.T., 2001; Burkhart H.M. and Cikrit D.F., 1997; Dixon B.S. et al., 2002; Turmel-Rodrigues L. et al., 1997], через 3 года - 57% [Berardinelli L. and Vegeto A., 1998], а среднее время функционирования - 4 года [Rodriguez J.A. et al., 1999].
Такие показатели эффективности позволяют практически полностью отказаться от других видов АВФ в дистальной части предплечья (между a. ulnaris и v. cephalica, a. ulnaris и v. basilica с транспозицией последней) как более сложных в хирургическом плане, менее удобных и надежных в эксплуатации. Целесообразность формирования АВФ в так называемой анатомической "табакерке" дискутабельна. По нашему мнению, недостатки метода (создание соустья между сосудами в области их минимального диаметра, а также косметические неудобства для пациента) не способствуют его широкому применению, даже с учетом его достоинств (достижение максимальной длины фистульной вены, близкое расположение анастомозируемых сосудов) [Wolowczyk L. et al., 2000].
Для ряда больных формирование функционально полноценных дистальных АВФ проблематично или невозможно в силу объективных причин (склероз или кальциноз a. radialis при сахарном диабете или атеросклерозе, рассыпной тип строения поверхностных вен, недостаточный диаметр сосудов, значительный слой подкожной жировой клетчатки, выраженная гипотония, гиперкоагуляция). В этом случае первичный вариант ПСД у такой категории пациентов соответствует видам АВФ, используемым на II этапе.
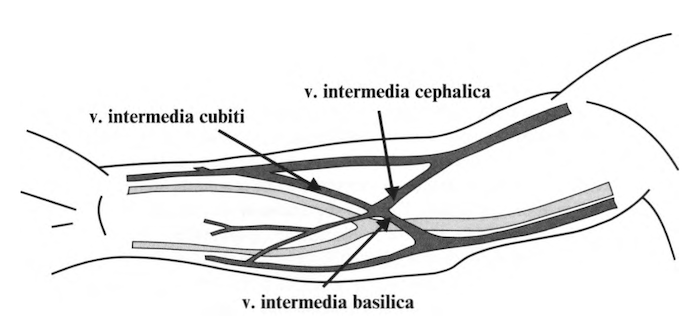
Второму этапу соответствуют нативные АВФ, для формирования которых, в зависимости от топографо-анатомических особенностей сосудистого русла, используются a. brachialis (или ее ветви в непос редственной близости от нее) и поверхностные вены локтевой области (рис. 3). При выборе вены приоритет в порядке очередности отдается v. intermedia cubiti (в этом случае кровоток через v. intermedia cephalica и v. intermedia basilica осуществляется одновременно в бассейн V. cephalica и v. basilica), v. intermedia cephalica, v. cephalica (при этом в большинстве случаев требуется выполнить ее мобилизацию на относительно большом протяжении). Как крайний вариант с целью отсрочки операций с использованием ССП все большее распространение получают АВФ, созданные путем анастомозирования a. brachialis (или одной из ее ветвей) с v. intermedia basilica или v. basilica с транспозицией последней [Butterworth Р.С. et al., 1998; Humphries A. Jr. et al., 1999; Lindner J., 1997; Matsuura J.H. et al., 1998; Murphy G.J. et al., 2000; Sands J.J., 2000; Gibson K.D. et al., 2001; Zielinski C.M. et al., 2001; Oliver M.J. et al., 2001].
На третьем этапе для создания ПСД возникает необходимость в имплантации ССП, так как все возможности использования поверх ностных вен пациента отсутствуют или уже исчерпаны. В первую очередь рассматривается возможность анастомозирования ССП с глубокими сосудами верхней конечности (а. и v. brachialis). Анастомозирование с магистральными сосудами нижней конечности (а. и v. femoralis, v. saphena magna) менее предпочтительно, так как при такой локали зации сосудистого протеза возрастает вероятность развития серьез ных осложнений (инфицирование, кровотечение) [Cull J.D. et al., 2004]. Кроме этого, более затруднен гигиенический уход за зоной пункций ССП, а у пациента может возникать дискомфорт при ходьбе.
После исчерпания ресурсов сосудов конечности может быть принято решение о формировании так называемых нестандартных видов ПСД. ССП также имплантируется в подкожную жировую клетчатку, но анастомозируется с магистральными сосудами шеи (сонные артерии и яремные вены) и (или) туловища (подключичные, подвздошные сосуды).
Подчеркнем, что переход от одного этапа к другому может осуществляться на разных сроках лечения, но только в тех случаях, когда полностью реализованы возможности предыдущего этапа в обеспечении пациента функционально полноценным ПСД.
Помимо основных оперативных вмешательств с задачей формирования одного из видов ПСД на каждом из этапов могут выполняться различные реконструктивные операции, целью которых является поддержание, восстановление или улучшение функции сосудистого доступа. Частота и характер таких вмешательств зависит от причины и степени выраженности развившихся осложнений.
Окончательное принятие решения о выборе оптимального вида ПСД для конкретного больного возможно только после уточнения анамнеза, характера основного и сопутствующих заболеваний пациента, оценки состояния сосудов (включая инструментальные методы), планируемых для формирования ПСД.
